新闻中心
青光眼(glaucoma)是一组视网膜神经节细胞及其轴突变性的进行性视神经病,其典型临床特征为视乳头凹陷性萎缩和特征性视野缺损,遗传因素在其发病过程中起着重要作用。本指南主要介绍单基因变异相关的青光眼,包括原发性先天性青光眼(primary congenital glaucoma,PCG)和原发性开角型青光眼(primary open-angle glaucoma,POAG)的致病基因、疾病诊断以及临床咨询等方面,旨在规范单基因青光眼临床分子遗传诊疗,为临床医生对单基因青光眼诊治和遗传咨询服务提供参考。
今天主要跟大家介绍原发性先天性青光眼(PCG)。
1.青光眼分类
青光眼是全球最常见的不可逆转致盲眼病。视网膜神经节细胞的进行性丧失是其主要的病例改变。
依据前房角形态、病因学及发病年龄等因素,通常将青光眼分为以下3种主要类型:
⏩原发性先天性青光眼(primary congenital glaucoma,PCG)。PCG是儿童最常见的青光眼类型,约占后者的25%,占青光眼总体的1~5%。
⏩ 原发性青光眼(primary glaucoma)包括原发性开角型青光眼(primary open-angle glaucoma,POAG)和原发性闭角型青光眼(primary angle-closure glaucoma,PAGG)
⏩ 继发性青光眼(sencondary glaucoma)
2.原发性先天性青光眼(PCG)遗传特点
遗传因素在青光眼发病中扮演重要角色,尤其是POAG和PCG可能为单基因变异所致。
▶ PCG的遗传特点:大量PCG患者来自同一家族或近亲婚配的家系,主要表现为具有可变外显率的常染色体隐性遗传。
▶PCG遗传方式:以散发病例为主,主要是常染色体隐性遗传。
3.临床表现
根据其发病年龄,可将PCG分为3种亚型:
·出生时或出生后1月内发病的新生儿型
·1月龄至2岁发病的婴儿型
·以及2~3岁发病的晚发型
80%的PCG患者在1岁前发病;患儿在早期即可视野缺损、视力减退。视功能损害难以逆转,缺乏根治的方法(尤其对于晚期患者),手术治疗风险大。PCG发病机制尚未清楚。
4.流行病学
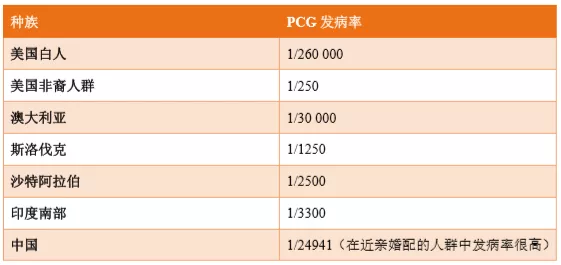
PCG是一种罕见病,其发病率为1/10 000,在不同种族中差异较大(表1)。PCG是儿童期致盲的主要疾病之一,在中国占儿童视力致残的6.3%
表1 各种族PCG发病率统计
5.发病机制
5.1 致病基因
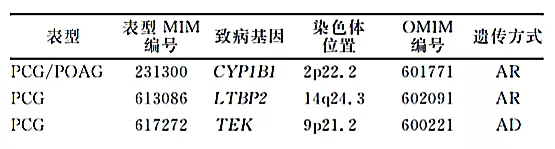
目前已鉴定的PCG致病基因有3个:CYP1B1、LTBP2、TEK(表2)。有报道称MYOC和FOXC1基因也可能与PCG有关。
表2 PCG致病基因
5.2 基因型与表型的对应关系
CYP1B1基因变异导致20~90%的家族性PCG以及27%~33%的散发性PCG。
在中国人群中,仅17.2%的PCG病例携带CYP1B1基因变异。
5.3 病理生理学及机制
PCG是由于胚胎期房角结构发育异常,导致房水引流不畅、眼压升高而造成视神经损害。
房角发育不良的原因目前尚不清楚。
6.疾病诊断
6.1 临床诊断
畏光、流泪、眼睑痉挛是PCG的三大体征,部分患儿可以仅表现为角膜水肿或雾状混浊。如果新生儿或婴幼儿有以上表现,则应考虑做如下检查:
6.1.1 外眼检查
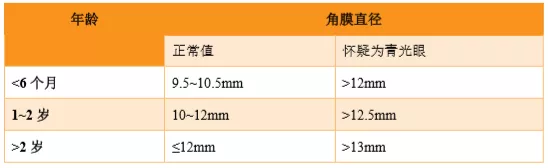
(1)角膜直径:不同年龄段的诊断标准如下表3。任何年龄的儿童眼角膜直径≥13mm均强烈提示异常。
表3 不同年龄段角膜直径的诊断标准
(2)角膜水肿:为眼压升高的直接结果。
(3)屈光不正:眼压升高、眼球扩大而产生的屈光不正如近视、散光变化等。
6.1.2 眼压测量
推荐使用Penkins压平眼压计和Tono-Pen眼压计。
新生儿和早产儿的平均眼压为9.59±2.30mmHg。患先天性青光眼的婴儿在未麻醉时眼压为30~40mmHg。在麻醉情况下,则需考虑麻醉药物对眼压的影响,推荐使用水合氯醛对儿童进行镇静后再进行眼压测量。
6.1.3 裂隙灯检查
推荐使用手持式裂隙灯。
角膜常见由于后弹力层引起的Haab条纹,可单一或多个存在,出生时诊断为先天性青光眼的患儿有25%出现Haab条纹,在6个月时则有60%的患者出现此条纹。
前房深,虹膜表现正常。部分患者存在虹膜基质发育不全、隐匿丧失等表现。
6.1.4 房角镜检查
前房角评估对准确诊断PCG十分重要。
儿童期前房角最具特点的是小梁网,它在出生第一年内外观光滑均匀,随着年龄的增加会变得粗糙并有色素沉着。
6.1.5 眼底镜检查
视神经乳头评估是诊断和评估PCG最有效的方法之一。
正常的新生儿视神经乳头呈粉红色。儿童期青光眼视神经萎缩,垂直苍白区的神经阻滞丧失明显,视神经乳头凹陷较成人进展快,但及时治疗可逆转。
6.2 基因诊断
建议用高通量测序技术针对PCG的已知致病基因检测CYP1B1、LTBP2、TEK等进行检测。
在CYP1B1基因突变数据库中约17%的变异为大片段缺失,6%为大片段重复;部分患者可能携带TEK基因重复变异,可采用qPCR或MLPA检测大片段重复/缺失变异。
6.3 产前诊断与胚胎植入前诊断
PCG发病早,患者就诊时往往已有严重的视神经损害,治疗效果较差。
由于本病在胎儿期缺乏明显的结构异常,无法借助超声或磁共振成像等进行筛查和诊断,建议借助产前诊断与胚胎植入前诊断进行干预。
推荐确诊为PCG的患者及其直系亲属寻求遗传咨询,讨论疾病的遗传方式、家系成员的患病风险、相应的检查及基因检查的作用、适应症、结果解读及可能造成的影响、计划生育、以及产前/症状前诊断。
基于目前的突变数据,CYP1B1基因相关的PCG可通过胚胎植入前或产前基因诊断预防,LTBP2和TEK基因变异相关的PCG临床处置需积累过多的数据。
7.临床遗传咨询
7.1 治疗方法
对于PCG,长期药物治疗副作用大、作用小,手术降低眼压是其主要的治疗措施。
7.2 风险评估
PCG主要呈常染色体隐性遗传,但TEK基因变异所致为常染色体显性遗传。
·常染色体显性遗传PCG:大多数先证者的父亲或母亲为携带者且其有相同或相似的症状。若父母之一为携带者,先证者的兄弟姐妹的患病风险为50%。
·常染色体隐性遗传PCG:多见于近亲婚配家庭。若父母均为携带者,则患者的兄弟姐妹有25%的概率患病,50%概率为携带者,25%的概率为野生型。常染色体隐性遗传PCG的患者若与正常人结婚生育,其后代均为致病变异携带者。在对患者的其他亲属进行检测前,需明确患者的致病变异。
