学术资源
一则“表型-致病性双管驱动”的产前案例
患者基本信息
孕妇
年龄:21岁
表型:智力低下、胎儿产前超声示心脏结构异常,房间隔缺损。
检测项目:OmniSeek产前全外显子组检测
对WES数据进行分析,发现如下可疑变异:
疾病介绍
人类孟德尔遗传学(OMIM)数据库中记载,RAI1基因的致病性变异可导致常染色体显性遗传的Smith-Magenis综合征(Smith-Magenis syndrome, SMS)。
SMS疾病特征
SMS是一种影响身体许多部位的发育障碍,主要特征包括轻度至中度智力低下、语言落后、面部特征独特、睡眠障碍和行为问题(包括经常发脾气和暴躁、攻击性行为、焦虑、冲动、难以集中注意力和自我伤害)。心脏缺陷在SMS患者中比较罕见。

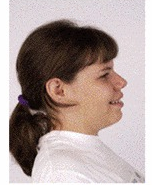
F,12y,多数SMS患者有一张宽阔的方形脸,眼睛深陷,脸颊饱满,下颌突出
(引用GeneReviews,https://www.ncbi.nlm.nih.gov/books/NBK1310/)
评级证据
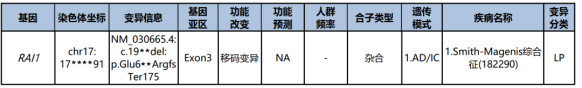
PVS1:RAI1基因变异c.19**del为移码变异(frameshift),属于功能缺失性变异(LoF)。已知LoF是Smith-Magenis综合征的致病机制(ClinGen HI 值=3),该变异位于第3号外显子(共6个外显子),且该外显子位于生物学相关转录本中。
PM2_Supporting :GnomAD数据库、ExAC数据库、千人基因组数据库、金诺自建数据库均未收录该变异。
根据现有产前影像学结果,综合考虑:RAI1基因变异c.19**del被视为候选变异,且推测该变异可能遗传自母亲。
下一步:Sanger验证,以明确变异来源。
Sanger验证结果提示,受检者RAI1基因变异c.19**del遗传自父亲。但根据提供的临床信息,受检者母亲有异常表型,表现为智力低下,验证结果与家族史有矛盾。
难道父母样本搞混了?
为此,我们对父母样本重新进行了验证,同时,进行了SRY(位于Y染色体上的性别决定基因)检测以排除样本搞混的可能,结果显示RAI1基因变异c.19**del确实遗传自父亲。
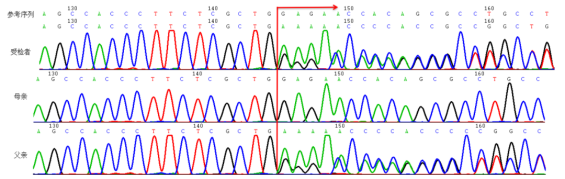
受检者及其父母RAI1基因变异c.19**del Sanger测序验证结果示意图
验证结果加重了我们的疑惑,我们决定再去确认下父亲是否真的无异常。
根据与临床沟通,得知父亲确实有一些轻微的异常,包括驼背、嗜睡、说话含糊不清、智力稍低于正常人。
(引用Expert Rev Mol Med. 2011 Apr 19;13:e14.)
睡眠障碍是SMS的典型特征,通常在生命早期开始。受影响的人白天可能很困,但晚上很难入睡,晚上和凌晨醒来多次。SMS的其他症状包括身材矮小、脊柱异常弯曲、对疼痛和温度的敏感性降低,以及声音嘶哑等。本案例中父亲有嗜睡,正是睡眠障碍的表现形式之一;父亲驼背可能与脊柱异常相关。
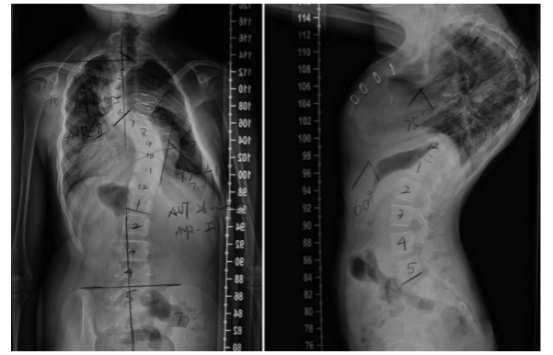
1例SMS患者的站立位脊柱正位和侧位X线片
(引用Medicine (Baltimore). 2015 May;94(17):e705.)
结论
受检者检出的RAI1基因变异c.19**del遗传自父亲,评级为可能致病性变异,或可解释受检者“心脏结构异常”和父亲“驼背、嗜睡、说话含糊不清、智力稍低于正常人”的临床表型。
因未获得母亲的基因组数据,因此母亲无法针对“智力低下”进行遗传病因学分析。
01.二代测序数据分析遵循表型驱动(Phenotype-driven)原则,而对于临床表型有限的产前样本,还需遵循致病性驱动(Pathogenicity-driven)原则,重点关注烈性变异,即倾向于(可能)致病性的变异。同时数据分析不能与临床孤立,精准的分析结果离不开与临床的紧密沟通。
02.基于现有检测方案表明,核心家系模式的WES检测,其临床获益明显高于单人模式。